2025知到答案 大学化学(山东联盟)(中国石油大学(华东)) 最新智慧树满分章节测试答案
绪论 单元测试
1、单选题:
以下化学的分支学科中,哪一个是化学学科的理论核心?( )
选项:
A:物理化学
B:分析化学
C:有机化学
D:无机化学
答案: 【物理化学】
2、判断题:
有机化学可以被称为“碳的化学”,研究碳氢化合物及其衍生物。( )
选项:
A:错
B:对
答案: 【对】
3、判断题:
空气质量报告中污染物的定性和含量测定都属于分析化学的范畴。( )
选项:
A:对
B:错
答案: 【对】
第一章 单元测试
1、判断题:
热和功是状态函数。( )
选项:
A:错
B:对
答案: 【错】
2、判断题:
体系和环境的划分是相对的。( )
选项:
A:错
B:对
答案: 【对】
3、判断题: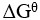 =0,意味着体系处于平衡态。( )
=0,意味着体系处于平衡态。( )
选项:
A:错
B:对
答案: 【错】
4、判断题:
一个反应的ΔG值越负,其自发进行的倾向越大,反应速率越快。( )
选项:
A:对
B:错
答案: 【错】
5、判断题:
在298K时,Mg的熵为零。( )
选项:
A:对
B:错
答案: 【错】
6、判断题:
熵增反应是自发反应。( )
选项:
A:对
B:错
答案: 【错】
7、判断题:
热力学第一定律是公理。( )
选项:
A:错
B:对
答案: 【对】
8、判断题:
ΔG < 0,反应自发进行。( )
选项:
A:错
B:对
答案: 【错】
9、判断题:
U和ΔU都是状态函数。( )
选项:
A:对
B:错
答案: 【错】
10、判断题:
任何过程的熵就是该过程的热温商。( )
选项:
A:错
B:对
答案: 【错】
11、单选题:
实际气体和理想气体更接近的条件是( )。
选项:
A:高温高压
B:低温低压
C:低温低压
D:高温低压
答案: 【高温低压】
12、单选题:
NH4NO3能溶于水,是一吸热过程,下列答案正确的是( )。
选项:
A:ΔG<0, ΔH>0, ΔS<0
B:ΔG<0, ΔH>0, ΔS>0
C:ΔG>0, ΔH>0, ΔS>0
D:ΔG<0, ΔH<0, ΔS>0
答案: 【ΔG<0, ΔH>0, ΔS>0】
13、单选题:
封闭体系是指该体系与环境之间( )。
选项:
A:只有物质交换,没有能量交换
B:有物质和能量交换
C:没有物质交换,只有能量交换
D:没有物质和能量交换
答案: 【没有物质交换,只有能量交换】
14、单选题:
有一个盛满热水的烧杯,当研究烧杯中的热水时,则此体系为( )。
选项:
A:敞开体系
B:封闭体系
C:孤立体系
D:绝热体系
答案: 【敞开体系】
15、单选题:
对任一过程( )。
选项:
A:体系的焓与途径无关
B:体系的内能变化与途径无关
C:体系所做的功与途径无关
D:体系所吸收的热量与途径无关
答案: 【体系的内能变化与途径无关】
16、单选题:
下列反应中ΔS<0的反应为( )。
选项:
A:CO2(s) = CO2(g)
B:2H2O(l) = 2H2(g) + O2(g)
C:
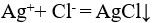
D:Na2S + 2HCl = H2S↑+ 2NaCl
答案: 【
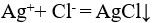
】
17、单选题:
公式 Qp = ΔH 的适用条件是( )。
选项:
A:恒压不做非体积功的过程
B:恒压须做体积功的过程
C:恒容过程
D:恒压过程
答案: 【恒压不做非体积功的过程】
18、单选题:
下列反应中,吉布斯函数变符合标准生成吉布斯函数定义的反应是( )。
选项:
A:S(单斜) + O2(g) = SO2(g)
B:1/2 H2(g) + 1/2 I2(g) = HI(g)
C:Na(s) + 1/2 Cl2(g) = NaCl(s)
D:2C(石墨) + O2(g) = 2CO(g)
答案: 【Na(s) + 1/2 Cl2(g) = NaCl(s)】
19、单选题:
已知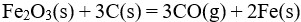 反应的
反应的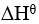 为正,
为正,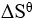 为正(假定
为正(假定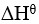 和
和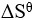 不随温度而变),下列说法正确的是( )。
不随温度而变),下列说法正确的是( )。
选项:
A:低温下自发过程,高温下非自发过程
B:任何温度下均为自发过程
C:高温下自发过程,低温下非自发过程
D:任何温度下均为非自发过程
答案: 【高温下自发过程,低温下非自发过程】
20、单选题:
在1173K,101.3kPa时,某反应的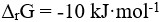 ,这表明( )。
,这表明( )。
选项:
A:该反应是放热反应
B:该反应在1173K和101.3kPa条件下,反应是自发的
C:该反应在任何条件下均不自发
D:该反应是自发反应
答案: 【该反应在1173K和101.3kPa条件下,反应是自发的】
第二章 单元测试
1、判断题:
可逆吸热反应的平衡常数随温度升高而增大。( )
选项:
A:错
B:对
答案: 【对】
2、判断题:
正催化剂能改变反应历程,降低反应活化能,但不能改变反应的标准吉布斯函数变。( )
选项:
A:错
B:对
答案: 【对】
3、判断题:
只要温度不变,可逆反应反应物的平衡转化率就不变。( )
选项:
A:对
B:错
答案: 【错】
4、判断题:
复杂反应机理的每一步反应必须是基元反应。( )
选项:
A:对
B:错
答案: 【对】
5、判断题:
温度不变,增大浓度,活化分子百分数不变,活化分子浓度增大。( )
选项:
A:对
B:错
答案: 【对】
6、判断题:
过渡态理论中,过渡态处于能量面的极大点,而中间体处于能量面的极小点。( )
选项:
A:错
B:对
答案: 【对】
7、判断题:
化学反应级数可以是正数、负数或零。( )
选项:
A:对
B:错
答案: 【对】
8、判断题:
升高温度,活化分子百分数不变,活化分子浓度增大。( )
选项:
A:错
B:对
答案: 【错】
9、判断题:
某物质是某正反应的催化剂,也一定是该反应逆反应的催化剂。( )
选项:
A:错
B:对
答案: 【对】
10、判断题:
反应级数和反应分子数不是一个概念。( )
选项:
A:对
B:错
答案: 【对】
11、单选题:
在密闭容器中盛有NO2气体,在等温下建立下列平衡:2NO2(红棕色)= N2O4(无色),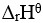 <0,若降低温度,则颜色将( )。
<0,若降低温度,则颜色将( )。
选项:
A:变浅
B:不一定
C:变深
D:不变
答案: 【变浅】
12、单选题:
反应速率的质量作用定律只适用于( )。
选项:
A:实际能进行的反应
B:化学反应式中各物质计量系数均为1的反应
C:非基元反应
D:一步完成的简单反应
答案: 【一步完成的简单反应】
13、单选题:
升高温度加快反应速率的主要原因是( )。
选项:
A:增加了分子的碰撞次数
B:提高了活化分子百分数
C:降低了反应的活化能
D:使平衡发生移动
答案: 【提高了活化分子百分数】
14、单选题:
一个化学反应达到平衡时,下列说法中正确的是( )。
选项:
A:各物质浓度或分压不随时间改变而改变
B:
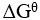 = 0
= 0
C:正、逆反应的速率常数相等
D:各反应物和生成物的浓度或分压相等
答案: 【各物质浓度或分压不随时间改变而改变】
15、单选题:
下列说法错误的是( )。
选项:
A:反应速率的过渡态理论也称绝对反应速率理论
B:1918年,Lewis提出反应速率的碰撞理论,Lewis是美国化学家
C:反应速率的碰撞理论在气体分子运动论基础上提出的理论
D:反应速率的过渡态理论又称活化配合物理论
答案: 【1918年,Lewis提出反应速率的碰撞理论,Lewis是美国化学家】
16、单选题:
下列说法错误的是( )。
选项:
A:对于一个基元反应,根据微观可逆原理,正逆反应经过同一个过渡态
B:一个基元反应,只对应一个过渡态
C:非基元反应多于一个过渡态
D:非基元反应的表观活化能不可能为负值
答案: 【非基元反应的表观活化能不可能为负值】
17、单选题:
下列对于催化剂的描述,错误的是( )。
选项:
A:催化剂分正催化剂和负催化剂
B:催化剂具有选择性
C:催化剂能够影响化学反应的热力学性质
D:正催化剂能改变反应途径,降低反应的活化能,从而导致反应速率增大
答案: 【催化剂能够影响化学反应的热力学性质】
18、单选题:
下列说法正确的是( )。
选项:
A:加入催化剂,平衡向吸热反应方向移动
B:升高温度,正逆反应速率都增大
C:增加反应物的量,平衡正向移动
D:增大压力,平衡向气体分子数小的方向移动
答案: 【升高温度,正逆反应速率都增大】
19、单选题:
已知反应2SO2(g) + O2(g) = 2SO3(g)在某温度下达到平衡时气体的分压,SO2为22.4kPa,O2为33.0kPa,SO3为46.0kPa。则该温度下上述反应的标准平衡常数为( )。
选项:
A:0.0622
B:7.81
C:0.128
D:12.9
答案: 【12.9】
20、单选题:
某化学反应在298K时的标准自由能变为负值,则该温度时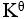 是( )。
是( )。
选项:
A:
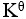 >1
>1
B:
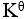 =1
=1
C:
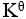 <1
<1
D:
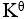 =
=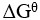
答案: 【
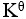 >1
>1
】
